Mieloma multiplo e tossicità oculare
Il mieloma multiplo è una neoplasia plasmacellulare caratterizzata dalla proliferazione di plasmacellule monoclonali. La gammopatia monoclonale di incerto significato (MGUS) è una condizione che precede la progressione a Mieloma.
Sia la condizione di MGUS che i casi di Mieloma si caratterizzano nella maggior parte dei casi per la presenza nel sangue e/o nelle urine di gammaglobuline anomale clonali, definite come componente monoclonale.
Dal punto di vista epidemiologico il mieloma multiplo rappresenta circa 1.8 % di tutte le malattie neoplastiche. Si tratta della seconda più frequente neoplasia maligna ematologica dopo il linfoma.
Sesso maschile, età avanzata ed etnia afroamericana rappresentano i tre principali fattori di rischio.
Rimane ad oggi una patologia inguaribile.
Negli ultimi anni però, grazie alle nuove terapie, l’aspettativa di vita è notevolmente aumentata.
Farmaci e tossicità oculare
Quello della tossicità oculare da farmaci è un capitolo della medicina in continua espansione.
I progressi nelle terapie farmacologiche hanno consentito di trovare un’efficace risposta farmacologica a patologie un tempo intrattabili.
Tuttavia quotidianamente ci troviamo di fronte alle più varie tipologie di tossicità, comprese quelle che interessano le strutture oculari.
Tutte le strutture oculari possono essere bersaglio di specifiche tossicità farmacologiche.
La terapia del mieloma multiplo
La disponibilità crescente di farmaci biologici innovativi, negli ultimi anni ha migliorato significativamente l’outcome dei pazienti con mieloma, integrandosi o sostituendosi progressivamente alla chemioterapia standard.
Una delle maggiori innovazioni terapeutiche per il trattamento del mieloma disponibile dagli anni 90 e ancora attuale, è il trapianto autologo di cellule staminali periferiche. Questo approccio si utilizza nei pazienti fino a 70 anni purché senza significative comorbidità.
Lo standard of care attuale prevede l’utilizzo di diverse classi di farmaci biologici: gli immunomodulatori (IMiDs – immunomodulatory imide drugs), gli inibitori del proteasoma (PIs) e gli anticorpi monoclonali (mAbs).
Nel 2021 la FDA ha approvato la prima terapia con cellule CAR T (Chimeric Antigen Receptor T-cell therapies) per il trattamento del mieloma multiplo.
Questo nuovo approccio terapeutico sta trovando sempre più applicazione nella terapia delle patologie ematologiche e prevede di raccogliere le cellule T del paziente e di ingegnerizzarle geneticamente in modo tale da dirigerne l’azione contro antigeni specifici delle cellule tumorali bersaglio.
Le cellule bioingegnerizzate vengono poi reinfuse al paziente. Risale invece al 2020 l’approvazione da parte della FDA del farmaco protagonista della trattazione, il belantamab mafodotin.
Belantamab mafodotin appartiene alla famiglia degli ADC, antibody-drug conjugate, ovvero farmaci citotossici che vengono coniugati ad anticorpi monoclonali.
Studi clinici su belantamab mafodotin
Gli studi clinici che hanno portato all’approvazione di belantamab mafodotin sono lo studio DREAMM-1 (studio di fase 1) e lo studio DREAMM-2 (fase 2).
Nel corso del primo studio 38 pazienti affetti da forme recidivanti e refrattarie della malattia sono stati sottoposti a terapia con il farmaco ogni 3 settimane per un massimo di 16 trattamenti.
La dose somministrata era di 3.4 mg/kg e i risultati supportavano l’efficacia e la buona tollerabilità del belantamab mafodotin.
La risposta al farmaco si è avuta in 21 dei pazienti trattati (60%) con una mediana di durata della risposta pari a 14 mesi.
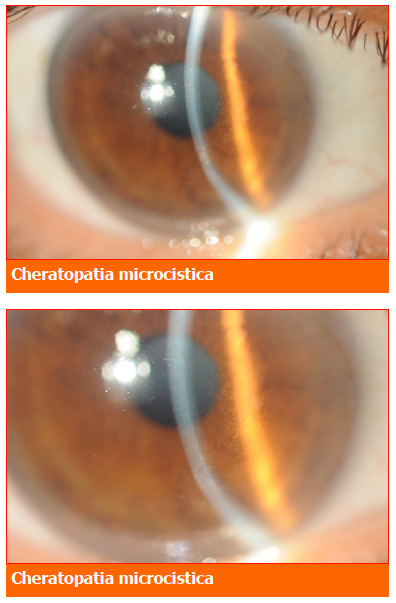
I principali effetti collaterali erano quelli a carico della cornea con la caratteristica cheratopatia microcistica, seguiti dall’anemia e dalla trombocitopenia.
Lo studio DREAMM-2 invece ha valutato quella che era l’efficacia e la tollerabilità di due diversi regimi terapeutici del farmaco.
I pazienti sono stati randomizzati in due bracci, uno con dosaggio di 3.4 mg/kg e l’altro con dosaggio di 2.5 mg/kg.
Gli effetti collaterali erano analoghi nei due gruppi e belantamab mafodotin ha dimostrato di essere efficace anche al dosaggio più basso, quello oggi utilizzato nella pratica clinica.
Coinvolgimento oculare da belantamab mafodotin
Diversi studi hanno dimostrato la presenza di belantamab all’interno delle lacrime di animali a cui era stato somministrato il farmaco.
Questo deporrebbe verso un meccanismo di danno off-target, visto anche che il tessuto corneale non esprime l’antigene di maturazione delle cellule B (BCMA).
Il farmaco verrebbe veicolato alla cornea dai vasi limbari e dalle lacrime, qui verrebbe poi internalizzato attraverso un meccanismo di macropinocitosi all’interno delle cellule epiteliali basali, senza che sia prevista interazione ligando-recettore.
Belantamab andrebbe quindi a legare la tubulina, inibendo la proliferazione cellulare e portando ad apoptosi.
Le cellule corneali si rigonfierebbero progressivamente fino a determinare modificazioni epiteliali di tipo microcistico.
Queste microcisti migrerebbero poi dalla periferia al centro della cornea determinando la classica sintomatologia visiva.
Di notevole importanza è il fatto che a essere danneggiate non siano solo i cheratinociti, ma anche le fibre del plesso nervoso corneale sub-basale.
Motivo per il quale molto spesso in questi pazienti abbiamo un notevole gap tra la riduzione dell’acuità visita, spesso notevole, e i sintomi di discomfort oculare, nettamente più blandi.
Nello studio DREAMM-1 gli sperimentatori hanno dimostrato come la tossicità corneale da belantamab fosse dose dipendente: il 63 % dei pazienti che avevano ricevuto il farmaco al dosaggio di 3.40 mg/kg sviluppavano tossicità corneale.
Lo studio DREAMM-2 riportava che il 73% dei pazienti presentava tossicità corneale e la sintomatologia che più di frequente si manifestava era visione offuscata seguita da secchezza oculare.
Gestione dei pazienti
Data l’elevata incidenza di effetti collaterali oculari diventa elemento chiave della gestione di questi pazienti la creazione di team multidisciplinare in cui ematologi e oculisti lavorino a stretto contatto.
La grande maggioranza dei pazienti affetti da complicanze oculari sia sintomatica, esiste però una porzione di pazienti che non lamenta disturbi agli occhi.
È importante che i pazienti prima dell’inizio del trattamento, effettuino uno screening con valutazione accurata dell’anamnesi oculare per poter rilevare eventuali variazioni dell’acuità visiva legate alla terapia con belantamab.
Generalmente i primi segni di tossicità si manifestano in genere a 3-5 settimane dall’inizio della terapia, tra il primo e il secondo ciclo.
Di fronte al manifestarsi di una tossicità oculare moderata l’indicazione è quella di sospendere momentaneamente il farmaco fino a quando la tossicità oculare è risolta.
Al ripristino del trattamento si può attuare una riduzione di dose e valutare un dilazionamento temporale delle dosi successive.
I casi di tossicità severa o ripetuta per i quali la sospensione definitiva del farmaco si rende necessaria sono rari.
La maggior parte degli eventi tossici oculari sono reversibili.
In alcuni casi, però, i tempi per ottenere una completa restitutio ad integrum sono lunghi e superano il mese.
Articolo tratto dalla lezione del Percorso Formativo Professione Oculista del Dr. Roberto Ceccuzzi “Affezioni corneali nella terapia sistemica del mieloma multiplo”.
Vuoi approfondire l’argomento? ACQUISTA SUBITO la lezione integrale.
Sei Medico Oculista oppure Ortottista? Iscriviti subito al Percorso Formativo Professione Oculista per avere 36 crediti ECM
Potrebbe interessarti anchequesto articolo: Retinopatia iatrogena: alcuni esempi di tossicità


